- 주기율표의 중요성을 강조한 과학자 중에는 물리학자인 미국의 리처드 파인만(Richard Feynman, 1918~1988년)도 있습니다. 그는 인류 가 멸망했을 때 다음 인류 혹은 생명에게 전해야 할 메시지를 한마디 로 요약해 달라는 질문에, "모든 것은 원자로 되어 있다.(All things are made of atoms.)”라고 답했다고 합니다. 화학자라면 아마도 말도 안 하 고 주기율표 한 장을 건네줬을 것 같습니다.
멘델레예프는 지독한 메모광이었다고 합니다. 새로운 아이디어가 떠오를 때마다 손에 잡히는 무엇에든 적어 두었으며, 이 기록들은 러 시아 상트페테르부르크 박물관에 잘 보관되어 있습니다. 또한 그는 훌륭한 선생님이기도 했습니다. 화학을 가르치면서 학생들이 원소 기 호와 특징을 잘 기억할 수 있도록 그는 각 원소에 대한 정보를 담은 카드를 여러 장 만들었고, 이것이 훗날 주기율표로 발전했습니다. 카 드를 원소의 질량 순서로 정리하다 보니 그 주기성과 특징이 드러났 고, 그렇게 정리된 카드들이 주기율표의 발명으로 이어졌다고 추정됩 니다.
- 선 스펙트럼에서 파장의 너비에 해당되는 선의 굵기는 다양합니 다. 매우 작기 때문에 맨눈으로 구별하기는 힘들지만, 약간씩 차이가 있습니다. 화학자들은 그 선들의 특징을 날카로움(sharp,s), 기본(principle, p), 분산(diffuse,d), 필수(fundamental, F)라는 이름으로 구분해 불렀으며, 그 것을 나중에 각운동량 양자수의 표기 수단으로도 사용했습니다. 각운 동량 양자수(1)를 0은 로, 1은 로, 2는 d로, 3은로 표기하는 것은 1920년대 독일 물리학자 프리드리히 헤르만 훈트(Friedrich Hermann Hund, 1896~1997년)가 처음 사용한 이후 오래된 관례처럼 내려오고 있 습니다.
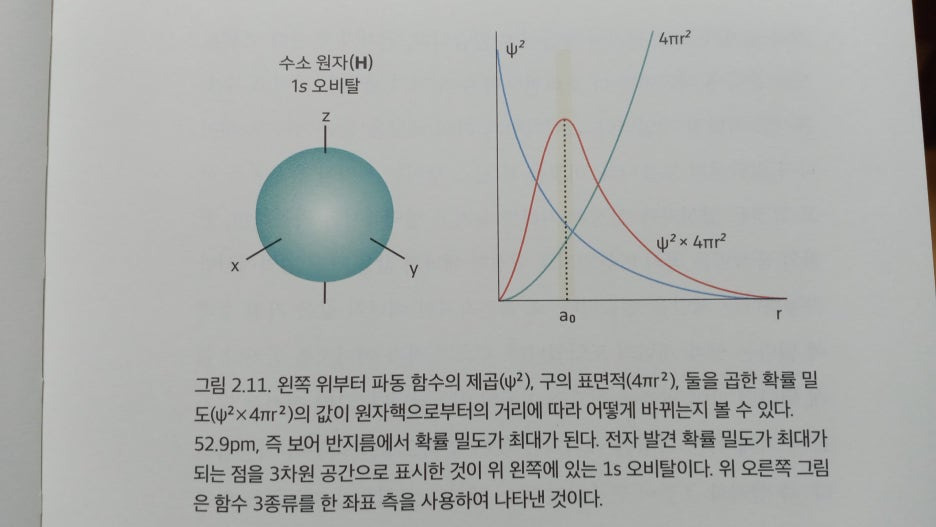
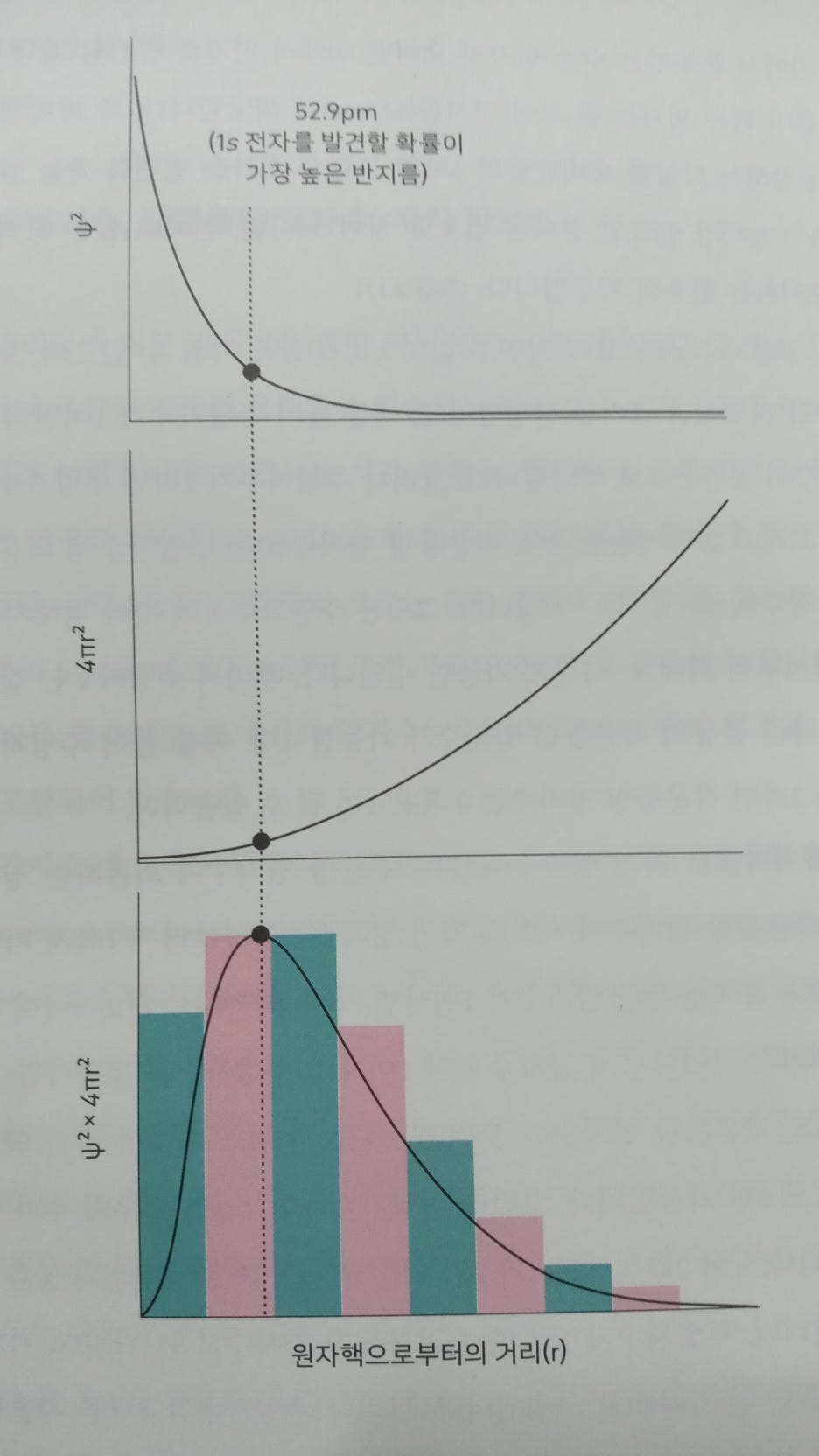
이제 여러분은 1s, 2s, 2P, 3s, 3D, 3d 같은 기호를 보아도 혼란스럽 지 않고 그 의미를 잘 파악할 수 있을 것입니다. 바로 전자의 주양자 수(1, 2, 3, ・・・)와 각운동량 양자수(s, p, d, J, ・・・ )를 동시에 표기한 것이기 때문입니다. 주양자수(m2)가 1일 때 각운동량 양자수(1)는 오직 0만 가 능하며, 그것은 1s 입니다. 주양자수가 2일 때 각운동량 양자수는 0과 1이 가능합니다. 각운동량 양자수가 0이면 2s, 각운동량 양자수가 1 이면 20입니다. 또한 2p 는 세 종류의 자기 양자수(1이 1이면 m2 = -1, 0, +1)가 가능합니다. 자기 양자수는 3차원 공간에서 오비탈의 방향성 을 나타내는 것으로 각운동량 양자수 표기(s, p, 4, 5, ・・・ )에 이어서 아래 첨자(예: x(-1), y(0), 2(+1))로 표시합니다. 여기서는 -1, 0, 2는 1이라고 예를 들었지만 그 수가 반드시 대응되는 것이 아니며, 세 종 류의 자기 양자수가 다르다는 사실을 나타내려고 구별한 것입니다.
- 일반 화학책에서 흔히 볼 수 있는 오비탈 그림들은 우리에게 익숙한 직교 좌표(x, y, z)를 사용해 전자의 발견 확률을 표시한 것입니다. 전 자 오비탈에서 주양자수가 2일 때 2s는 1개의 오비탈, 2D는 3개(2P) 2P, 2pm)의 오비탈이 있습니다. 2P는 표기법을 모르는 사람에게는 해 독 불가능한 암호같이 보이겠지만, 이제부터 독자들은 그것은 주양자 수가 2이고, 각운동량 양자수는 이며, 자기 양자수의 방향성(x, y, z) 은라는 정보를 담은 기호라고 이해할 수 있을 것입니다.
- 일반적으로 전자는 낮은 에너지의 오비탈부터 높은 에너지의 오비 탈 순으로 채워집니다. (이것을 쌓음 원리라고 합니다.) 그러므로 에너지 준 위가 낮은 4s 오비탈에 먼저 채워진 후에 3d 오비탈에 채워집니다. 그 런데 전자를 잃어버려 이온이 될 경우에는 4s 오비탈에 있었던 전자 가 먼저 오비탈에서 빠지고, 그 후 3d 오비탈에 있었던 전자가 빠집니 다. 에너지 준위가 4s보다 높은 3d 에 있는 전자들이 먼저 빠져야 하지 않을까 의문이 들겠지요? 그러나 전자들이 채워진 상태에서 4s 오비 탈의 에너지 준위는 더는 3d 오비탈의 에너지 준위보다 낮지 않습니 다. 전자들이 많아질수록 상호 반발과 원자핵과의 끌림으로 다른 환 경을 만들기 때문입니다. 즉 더 낮은 에너지의 오비탈을 차지하고 있 는 전자들은 높은 에너지의 오비탈에 있는 전자들에 대한 원자핵의 영향을 가리기 때문에 이것을 차폐 효과 혹은 가림 효과(shielding effect)라고 합니다.) 높은 에너지 오비탈에 있는 전자들은 자신들의 원자핵 지분인 +1 전하를 온전히 차지할 수 없는 상황이 됩니다.
또 다른 이유로 높은 에너지의 오비탈에서 전자가 빠진 후에 형성 된 이온의 에너지 상태가 더욱 안정된다면 4s 오비탈에서 전자가 먼 저 빠지는 것이 에너지 면에서 더 유리한 조건이 될 수도 있을 것입니 다. 전자들이 많아지면 서로 반발도 커지고, 원자핵의 영향이 가려지 기도 하고 혹은 더 받기도 하면서 많은 변화가 일어납니다. 사실 오비 탈들의 에너지 차이가 거의 비슷한 오비탈들에서 전자를 채우고 비우 는 것은 전체 에너지 안정에 도움이 되는 방향으로 변화를 겪기 때문 이라고 해석할 수 있습니다. 왜 그럴까요? 자연은 현상을 보여 주기만 하며 그것에 대해 설명해 주지 않습니다. 과학은 자연이 보여 주는 변 화를 인간의 눈으로 해석하고 설명하는 도구입니다. 그렇기에 과학은 '어떻게?'라는 질문에 다양한 해석은 가능하겠지만 '왜?'라는 질문에 대한 답이 매우 어렵습니다. 과학으로 생명이 태어나는 과정에 대한 설명은 가능해도 '왜 태어날까?'라는 근본 질문에 답을 줄 수 없는 것 과 같습니다.
- 전기 음성도를 물 분자에 적용해 보면 그 개념을 더 쉽게 이해할 수 있습니다. 물 분자의 중심에 있는 산소 원자의 전기 음성도는 수소 원자의 전기 음성도보다 커서, 결합에 참여하는 전자들은 산소 원자 쪽으로 더 끌려 있습니다. 따라서 물 분자에서 산소 원자 근처는 부분 음전하를, 수소 원자 근처는 부분 양전하를 띠게 되어 결과적으로 물 분자는 극성을 갖게 됩니다. 물을 극성 용매(polar solvent)라고 부르는 까 닭도 물 분자의 이런 특성을 반영한 것입니다.
- 우리 몸을 구성하는 원소의 종류는 약 30개입니다. 그런데 몸에서 1% 이상 질량을 차지하는 원소를 보면 고작 6개(산소(O), 탄소(C), 수소 (H), 질소(N), 칼슘(Ca), 인(P))에 불과합니다. 범위를 0.1% 이상의 원소로 확대해도, 단지 원소 5개(포타슘(K), 황(S), 소듐(Na), 염소(Cl), 마그네슘(Mg)) 가 추가될 뿐입니다. 이 원자들이 자기들끼리 혹은 다른 원자들과 결 합해 분자를 만들고, 분자들이 모여 눈에 보이는 물질이 되고, 그 물 질이 각자 제자리에 있어야 비로소 몸이 제대로 움직입니다. 참으로 기적 같은 일이 아닐 수 없습니다. 인체를 구성하는 원자는 몇 종류 되지 않지만, 몸에 있는 분자, 이온, 화합물의 종류는 정말 다양하고 기능도 제각각입니다.
- 분자오비탈 이론(molecular orbital theory)은 루이스 전자점 구조를 설명하는 원자가 결합 이론(valence bond theory)과 함께 원자의 결합 형식과 분 자의 결합 특성을 설명해 주는 이론입니다. 수소 전자를 예로 들자면 1s 오비탈들이 일직선 위에서 서로 다가서고 겹쳐지면서(중첩) 수소 분자가 형성된다는 것입니다. 각각의 수소 원자에 있는 전자들이 제 일 적절한 거리에 있을 때 계의 전체 에너지(퍼텐셜 에너지)는 최소가 되 어, 두 오비탈의 겹침이 최대의 안정을 이루기 때문에 수소 분자를 형 성합니다. 그러나 전자가 포함된 오비탈 영역이 더 가까워지면 결합 되는 수소 원자의 원자핵 2개도 서로 가까워집니다. 그 결과 같은 양 (+)전하를 띤 수소 원자핵들은 서로 반발해 오히려 계의 전체 에너지 를 높여서 결합의 안정성을 해치게 됩니다.
오비탈의 중첩으로 분자의 결합이 형성된다는 분자 오비탈 이론은 다양한 분자들의 결합 에너지와 결합 길이가 다른 이유를 설명할 수 있습니다. 수소 분자는 1s 오비탈의 중첩으로 결합이 형성되는 반 면, 플루오린 분자(F,(g))는 플루오린 원자의 2p 오비탈의 중첩으로 결 합이 형성됩니다. 그 결과 단일 결합이지만 중첩에 이용되는 전자 오비탈의 종류가 달라서 결합 에너지와 길이도 다릅니다. 결합이 형성될 때 전자가 운동하는 영역인 오비탈, 오비탈, d 오비탈의 중첩이 가능합니다. 따라서 매우 다양한 결합의 종류와 그에 따른 특성을 예 상할 수 있습니다. 이렇게 분자 오비탈 이론은 루이스 전자점 구조를 이용한 원자가 결합 이론보다 훨씬 더 세밀하게 분자의 특성(결합 길이, 결합 개수, 에너지)을 설명하는 이론으로 자리 잡고 있습니다.
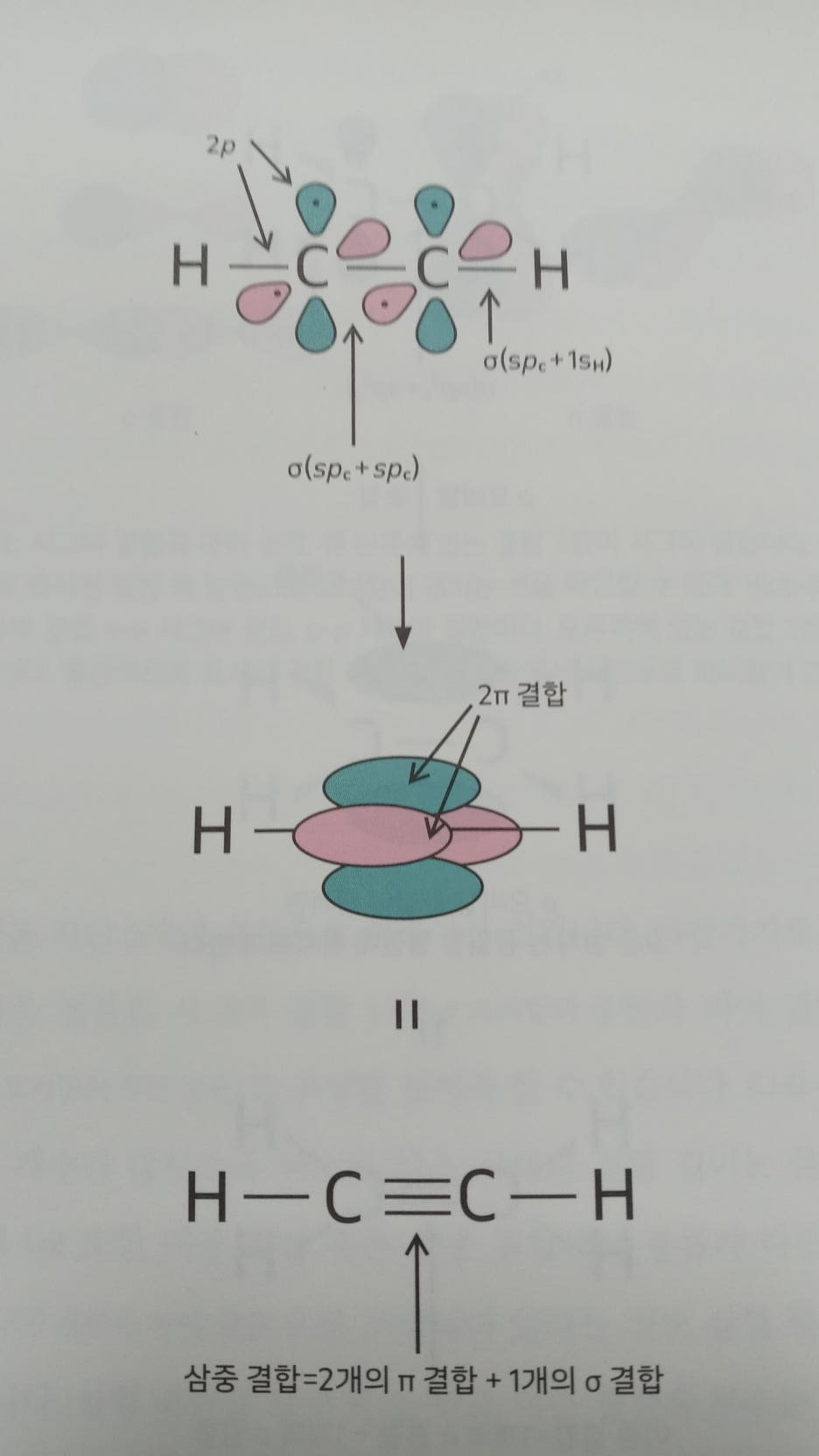
- 탄소는 탄소, 수소, 질소, 산소 등으로 이루어지는 유기 화합물 (organic compound)에서 중심이 되는 원자입니다. 탄소 원자들은 단일 결 합은 물론 이중, 삼중 결합으로 분자를 형성하는 것이 보통입니다. 혼 성 오비탈 이론(hybridized orbital theory)은 탄소 원자끼리, 혹은 다른 원자 와 결합할 때 탄소 원자는 새로운 형식의 오비탈을 형성하며, 그것을 이용해 결합이 형성된다는 이론입니다. 이 이론은 탄소 원자들끼리, 그리고 탄소 원자가 다른 원자와 결합한 분자의 특성을 모두 설명할 수 있으며 실험 자료와 일치하는 해석이 가능하기 때문에 현재까지 받아들여지고 있습니다.
혼성 오비탈 이론의 핵심은 s, p, d 등의 전자 오비탈들이 혼성체 (hybrid)를 이루어 새로운 형식의 혼성 오비탈(hybrid orbital)을 형성한다는 것입니다. 혼성 오비탈의 수는 그것을 만들 때 사용했던 원자 오비탈 의 수와 같은 개수만큼 형성됩니다.
- 혼성 오비탈 이론은 탄소와 탄소의 결합은 물론 탄소와 다른 종류 의 원자와 결합의 형성을 설명할 수도 있습니다. 또한 이 이론을 적용 하면 많은 분자들의 결합 특성과 실험 결과가 일치하는 해석이 가능 하다는 사실이 밝혀졌습니다. 혼성 오비탈 이론을 제시한 화학자 라 이너스 폴링은 화학 결합의 본질을 설명하는 이론을 제창했다는 공 로를 인정받아서 1954년 노벨 화학상을 받았고, 그 후 1962년에 노 벨 평화상을 받았습니다. 두 번째 노벨상의 근거는 핵에너지의 평화 적 이용을 위한 공헌과 노력에 대한 것이었습니다. 그는 또한 1932년 에 공유 결합들의 특성 차이를 설명하기 위한 전기 음성도 개념을 제 안했으며, 그것은 오늘날까지도 활용되고 있습니다.
- 세상에는 수많은 공유 결합 화합물이 있습니다. 공유 결합 화합 물은 이온 결합 물질과는 다르게 실온에서 기체 혹은 액체로 존재한 다는 점이 특징입니다. 우리가 잘 알고 있는 이산화탄소(CO2), 염산 (HCI), 이원자 분자들(H, N, O,)을 비롯한 수많은 유기 화합물이 바로 탄소와 다른 종류의 원자들이 공유 결합으로 형성되는 화학 물질입 니다. 공유 결합 화합물은 전자를 서로 공유하는 특성 때문에 분자들 이 극성을 띠는 일이 드뭅니다. (물 같은 분자들은 분자를 구성하는 원자들의 전기 음성도 차이가 크기 때문에 부분 전하를 띨 수도 있습니다.) 또한 물에 녹아 이온이 되면서 전기 전도성을 띠는 이온 결합 물질과는 달리 공유 결 합 물질들은 전기 전도성을 띠지 않는 것이 대부분입니다. 그러나 염 산처럼 물에 녹아 해리되어 양이온과 음이온으로 분리되는 경우에는 전기 전도성을 띠기도 합니다.
- 지금까지 알아보았던 아세트산, 구연산, 아스코르브산, 폼산 (HCOOH, 혹은 개미산) 등은 모두 유기산입니다. 혈관과 뇌 건강에 도 움을 준다고 알려진 오메가-3 지방산도 유기산입니다. 그러나 탄산 (H,CO)은 탄소를 가지고 있음에도 무기산으로 분류됩니다.
카복실기를 포함하는 대표적인 유기산으로 폼산과 아세트산 (CH,COOH)이 있습니다. 폼산의 수소(H) 혹은 아세트산의 메틸기 (CH) 자리에 탄소와 수소 원자들로 이루어진 다양한 종류의 분자 그 룹(R-)이 결합되어 있는 분자도 모두 유기산입니다. 동식물에 있는 수 많은 유기산은 적어도 1개 이상의 카복실기를 포함하고 있습니다. 카 복실기의 탄소를 포함해 탄소가 4개 이상 포함된 유기산을 지방산이 라 부릅니다. 그것은 여러 개의 탄소로 이루어진 분자 그룹(R)을 가 진 유기산이 체내 지방(fat) 분자에서 유래된 것에서 그 이유를 찾을 수 있습니다. 음식으로 먹은 지방(중성 지방)은 분해되면 카복실기를 포함하는 유기산(지방산)이 되고, 그 유기산들은 혈액에 녹아서 필요한 곳으로 운반됩니다. 그런 유기산 중에서 탄소의 수가 적은 유기산은 물에 녹지만, 탄소의 수가 많아서 분자 그룹이 마치 긴 사슬처럼 보이 는 유기산은 기름에 더 잘 녹습니다.
- 횟집에서 생선회를 먹기 전에 보통은 레몬즙을 뿌립니다. 레몬 향기를 좋아하는 사람도 있겠지만, 화학적으로는 생선의 아민 화합물을 레몬의 구연산과 반응시켜서 염으로 만들기 위해서입니다. 생선의 근육에 함유되어 삼투압을 조절하는 역활을 하는 아민은 코를 자극하 는 특유의 냄새가 납니다. 암모니아도 소위 '화장실 냄새'로 잘 알려 져 있지만, 암모니아의 수소 원자 대신에 분자 그룹(R-)으로 바뀐 아 민 화합물도 암모니아처럼 냄새가 고약합니다. 더구나 분자량이 작은 아민들은 차가운 생선회의 표면에서도 쉽게 증발합니다. 예를 들어 메틸아민(CH,NH, 끓는점 -6.3°C), 다이메틸아민((CH,), NH, 끓는점 7°C), 트라이메틸아민((CH), N, 끓는점 2.9°C) 같이 분자량이 작은 아민 화합물 은 모두 끓는점이 매우 낮기 때문에 실온에서 쉽게 기체로 변합니다. 그런 아민들이 레몬즙 속에 풍부하게 들어 있는 구연산(C.HO)과 반응하면 아민염이 됩니다. 즉 산 염기 반응이 진행된 것입니다. 아민염 은 물에 잘 녹기 때문에 생선회에 있는 물기에도 충분히 녹아, 아민이 증발해 기체가 되는 일을 막을 수 있습니다. 냄새의 원인을 없애는 데 화학 반응을 이용하는 것입니다. 냄새의 원인인 아민 분자를 구연산 과 반응시켜서 수용성 분자(염)로 변환하는 화학 반응이 바로 그것입 니다. 레몬이 없을 때는 구연산 음료 혹은 시큼한 맛이 나는 과일즙을 살짝 뿌려도 같은 효과를 얻을 수 있습니다.

'과학' 카테고리의 다른 글
| 과학자의 발상법 (0) | 2024.08.21 |
|---|---|
| 사피엔스의 뇌 (0) | 2024.08.17 |
| 호르몬은 어떻게 나를 움직이는가 (1) | 2024.07.27 |
| 유전자 지배사회 (2) | 2024.07.26 |
| 상상하는 공학 진화하는 인간 (15) | 2024.07.25 |




